Page 1 sur 1
Methode VSEPR
Publié : 29 octobre 2022, 10:51
par khira
Bonjour;
dans la colle sup de biochimie qu'on nous a distribué et plus précisément au niveau du QCM 11 je bloque un peu, il est indiqué que la molécule NH2- possède une géométrie tetragonale et qu'elle possède donc 2 doublets non liants pourtant je n'arrive à men représenter que 1 de meme pour l'item D ou la molécule CO3 2- est symbolisée par AX3E0 mais je ne comprends pas pourquoi. J'espère ne pas trop vous avoir perdu
Merci et bonne journée
Re: Methode VSEPR
Publié : 29 octobre 2022, 13:40
par Léopold
Salut,
Tout d’abord comme tu l’as bien compris c’est grâce à la méthode VSEPR que tu vas pouvoir déterminer la géométrie de ta molécule.
La molécule est symbolisée par :
AXnEm
- X : Ligand (n = nombre de ces ligands)
- E : Doublet non-liant (m = nombre de doublets non liants qui appartiennent à l’atome central)
La
somme des indices n et m permet de trouver la
géométrie de la molécule.
- n+m = 2 : géométrie linéaire
- n+m = 3 : géométrie triangulaire
- n+m = 4 : géométrie tétraédrique
Exemples :
- NH2- : la forme de cette molécule est tétraédrique. Pourquoi ?

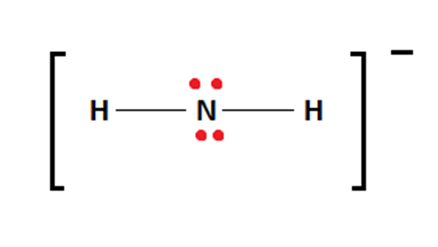
L’atome d’azote (A : l’atome central) est lié à
deux atomes d’hydrogène (n = 2) et possède
deux doublets non-liants (m = 2). NH2- est donc symbolisé par
AX2E2.

n+m = 2+2 = 4 : la géométrie de la molécule est bien
tétraédrique.
- CO3- : la forme de cette molécule est triangulaire. Pourquoi ?


L’atome de carbone (A : l’atome central) est lié à
3 atomes d’oxygène (n = 3) et possède
aucuns doublets non-liants (m = 0). CO3- est donc symbolisé par
AX3E0.

n+m = 3+0 : la géométrie de la molécule est
triangulaire.
J'espère avoir répondu à ta question, si tu n'as pas compris ou que tu as d'autres questions n'hésite pas. Tout l'équipage de Biochimie te souhaite bon courage pour la suite !!!

Re: Methode VSEPR
Publié : 30 octobre 2022, 08:24
par khira
Merci je comprends un peu mieux mais en réalité ce que je n'arrive pas a comprendre c'est plus la représentation de la molécule par exemple pour NH2- pourquoi autour de l'atome d'azote se trouve 2 paires d'électrons sachant que l'azote n'en a que 5 sur sa couche de valence et donc 2 électrons sont déjà liés à l'atome d'hydrogène il ne devrait en rester plus que 3 et non 4 c'est pour ça que lorsque je me représenter la molécule je n'ai trouvé que 1 doublets non liants. J'espere m'être bien expliqué et ne pas trop vous avoir perdu

Re: Methode VSEPR
Publié : 30 octobre 2022, 10:00
par Léopold
D'accord je crois comprendre ce qui te pose problème. Comme tu peux le remarquer, il s'agit d'un
anion (NH2-). L'atome d'azote N a donc
gagné un électron, ce qui va créer un doublet non-liant supplémentaire.
En regardant le schéma ci-dessous,
- Tu peux voir l'azote (à gauche) avec ces 5 électrons de valences (dans lequel on retrouve 1 doublet non-liant).
- Après lui avoir apporté un électron supplémentaire (formation d'un anion), on obtient 6 électrons de valences (dans lequel on retrouve donc 2 doublets non-liants). L'azote sous forme d'anion (N-) ne peut former que 2 liaisons (ici avec l'hydrogène) et non-plus 3.

Maintenant j'espère avoir compris ton questionnement et y avoir répondu

. Encore une fois si tu n'as pas compris ou que tu as d'autres questions n'hésite pas. N'hésite pas aussi à venir en perm' tuteur !!! Je te souhaite bon courage et bonne journée !
Re: Methode VSEPR
Publié : 30 octobre 2022, 13:02
par khira
merci je comprends mieux !!

